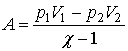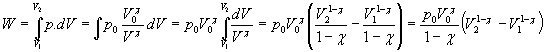I d e á l n y
p l y n
Termodynamické deje v ideálnom plyne
Definícia
Pri odvodzovaní zákonov
platných pre plyn sa namiesto reálneho plynu zavádza zjednodušený model, ktorý
nazývame ideálny plyn.
O molekulách ideálneho
plynu vyslovujeme tri predpoklady:
o
rozmery
molekúl ideálneho plynu sú zanedbateľne malé v porovnaní so strednou
vzdialenosťou molekúl
o
molekuly
ideálneho plynu nepôsobia na seba navzájom príťažlivými silami
o
vzájomné
zrážky molekúl ideálneho plynu a zrážky týchto molekúl so stenou nádoby sú
dokonale pružné
V každom okamihu sa
prevažná časť molekúl ideálneho plynu pohybuje voľne rovnomerným priamočiarym
pohybom. Keďže molekuly ideálneho plynu nepôsobia na seba navzájom silami, je
potenciálna energia sústavy molekúl ideálneho plynu nulová. Vnútorná energia
ideálneho plynu sa rovná súčtu kinetických energií jeho molekúl pohybujúcich sa
neusporiadaným posuvným pohybom pri normálnych podmienkach (tn=0 °C,
pn=1,013 25 . 105 Pa) možno
väčšinu plynov s dostatočným stupňom presnosti považovať za ideálny plyn.
Stavová rovnica
Stavová rovnica je jednou zo základných rovníc
termodynamiky a popisuje ako navzájom súvisia jednotlivé stavové veličiny. To
je užitočné, lebo nám umožňuje pre danú zmenu jednej zo stavových veličín
(napríklad zväčšenie objemu plynu) predpovedať, ako sa budú správať ostatné
stavové veličiny. Stavovú rovnicu môžeme napísať pre plyny okolo nás, ale
napríklad aj pre vnútro hviezd či celý vesmír.
Najznámejšou je stavová rovnica
ideálneho plynu
![]() ,
,
kde
p – je tlak plynu [Pa]
V – je jeho objem [m3]
N – je celkový počet jeho častíc
k – je Boltzmannova konštanta (1,38 10-23 J/K)
T – je teplota plynu [K].
Stavová rovnica sa odvádza
pomocou kinetickej teórie plynov. Najdôležitejšie je si uvedomiť, že tlak plynu
je daný odrazmi jeho molekúl od stien nádoby a hľadať rýchlosti, ktorými sa
tieto molekuly pohybujú (a odrážajú). Celé odvodenie je však pomerne
komplikované.
Stavová rovnica ideálneho plynu sa niekedy
zapisuje v trochu inom tvare, kedy je počet častíc nahradený ich mólovým
množstvom . Rovnica má potom tvar
![]() .
.
Konštanta R sa
nazýva univerzálna plynová konštanta a má hodnotu približne 8,31 J/mol.K. Jeden
mól plynu (n = 1) je také množstvo látky, ktoré obsahuje NA
častíc (molekúl, atómov), N = n NA
= 1 NA = 6,023.1023
mol-1 , kde NA
je Avogadrova konštanta, ktorá
predstavuje počet atómov, ktorý sa nachádza v 12 gramoch 12C.
Práca plynu
Najme valec
s pohyblivým piestom o ploche S, v ktorom sa nachádza plyn
o tlaku p a objeme V. Plyn pôsobí na piest silou F o veľkosti F
= p S kolmou na piest. V prípade posunutia piestu o vzdialenosť
dx (pri nezmenenom tlaku), vykoná elementárnu prácu:
![]()
Pre elementárnu prácu plynu teda platí: dA
= p dV
V prípade posunutia
piestu tak, že sa objem plynu zmení z hodnoty V1 na hodnotu V2, vychádza
pre prácu vykonanú plynom:
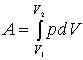
Rovnako veľkú prácu musia
vykonať aj vonkajšie sily na to aby sa objem plynu zmenšil z hodnoty V2 na
V1. Túto prácu voláme vonkajšia práca a podľa konvenkcie sa berie ako
záporná.
Prvá veta termodynamická
Prvá veta termodynamická vychádza z predpokladu, že
teplo je určitý druh energie a hovorí, že v izolovanej sústave v ktorej
dochádza k rôznym premenám energie, je súčet všetkých týchto energií
konštantný. Vyjadruje teda zákon zachovania energie. Prvá veta termodynamická
má tvar:
![]()
kde ΔU - zmena vnútornej
energie,
Q - teplo dodané sústave – plynu,
A - práca
vykonaná sústavou – plynom.
Vnútorná energia U charakterizuje stav sústavy a voláme
ju tiež stavovou funkciou.
Pri používaní 1. vety
termodynamickej sa dodržuje nasledovná znamienková konvekcia:
a)
teplo Q do sústavy dodané budeme
označovať znamienkom + a teplo, ktoré sústava odovzdá znamienkom –
b)
nárast vnútornej energie ΔU
je vždy kladný a jej úbytok bude záporný
c)
za kladnú budeme považovať prácu A,
ktorú sústava vykoná/odovzdá do prostredia a prácu, ktorú vykoná vonkajšie
prostredie na danej sústave, budeme označovať ako zápornú.
Termodynamické deje
v ideálnom plyne
Stavová rovnica platí pre každý dej v plyne. Z tejto rovnice môžeme získať rovnice
pre špeciálne prípady:
a)
Dej pri
ktorom je teplota plynu stála T = konšt sa nazýva izotermický
dej. Potom
![]()
Tieto rovnice sú matematickým vyjadrením Boyle-Mariottovho zákona. Indexy 1, 2
v druhej rovnici zodpovedajú dvom rôznym stavom plynu. graf vyjadrujúci
tlak plynu so stálou hmotnosťou ako funkciu jeho objemu pri izotermickom deji
sa volá izoterma.
Zmena
vnútornej energii plynu pri izotermickom deji sa rovná práci plynu A,
ktorú vykoná plyn pri svojej expanzii/kompresii z objemu V1
na objem V2:
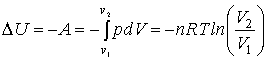
b)
Dej pri
ktorom je tlak plynu stály p = konšt. sa
nazýva izobarický dej pri Potom
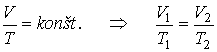
Pri izobarickom deji s ideálnym plynom stálej
hmotnosti je objem plynu priamo úmerný jeho termodynamickej teplote
(Gay-Lussacov zákon). graf, ktorý vyjadruje tlak plynu so stálou hmotnosťou ako
funkciu jeho objemu pri izobarickom deji, volá sa izobara.
Zmena vnútornej energii plynu
pri izochorickom deji je rovná teplu Q, ktoré príme plyn počas daného
deja:
![]()
kde n - je počet mólov
plynu a CV - je merná tepelná kapacita pri konštantnom
objeme.
c)
izochorický
dej pri V = konšt. Potom
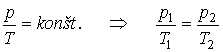
Pri izochorickom deji s ideálnym plynom
stálej hmotnosti je tlak plynu priamo úmerný jeho termodynamickej teplote (Charlesov
zákon). graf, ktorý vyjadruje tlak plynu so stálou hmotnosťou ako funkciu jeho
objemu pri izochorickom deji, volá sa izochora.
Zmena vnútornej energii plynu
pri izotermickom deji je rovná teplu Q, ktoré príme plyn počas daného
deja a práci plynu A, ktorú vykoná plyn pri svojej expanzii/kompresii
z objemu V1 na objem V2:
![]()
kde n - je počet mólov
plynu a CP - je merná tepelná kapacita pri konštantnom
tlaku.
d)
Pri
adiabatickom deji neprebieha tepelná výmena medzi plynom a okolím Q = 0 J,
takže podľa prvého termodynamického zákona platí:
![]()
Pri adiabatickom stlačení
plynu v nádobe sa pôsobením vonkajšej sily koná práca a teplota plynu i jeho
vnútorná energia sa zväčšujú. Pri adiabatickom rozpínaní prácu koná plyn a teplota
plynu i jeho vnútorná energia zmenšujú
Pre adiabatický dej
s ideálnym plynom platí Poissonov zákon:
![]()
kde χ je Poissonova konštanta,
pričom platí: 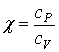 . Poissonova konštanta je vždy väčšia ako 1. Závisí od
druhu plynu (pre plyn s jednoatómovými molekulami χ = 3/2,
s dvojatómovými molekulami χ = 5/2).
. Poissonova konštanta je vždy väčšia ako 1. Závisí od
druhu plynu (pre plyn s jednoatómovými molekulami χ = 3/2,
s dvojatómovými molekulami χ = 5/2).
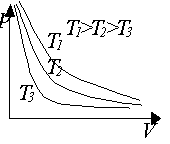
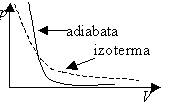 Graf, ktorý vyjadruje tlak plynu so stálou
hmotnosťou ako funkciu jeho objemu pri adiabatickom deji, volá sa adiabata.
Adiabata klesá vždy strmšie ako izoterma toho istého plynu s rovnakou
hmotnosťou.
Graf, ktorý vyjadruje tlak plynu so stálou
hmotnosťou ako funkciu jeho objemu pri adiabatickom deji, volá sa adiabata.
Adiabata klesá vždy strmšie ako izoterma toho istého plynu s rovnakou
hmotnosťou.
Práca vykonaná pri
adiabatickom deji:
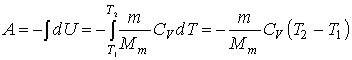
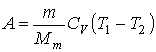
Ďalším z prakticky používaných tvarov pre vyjadrenie práce pri adiabatickom
deji dostaneme vylúčením teploty: